
|
Experiment des Monats
|
Bei der Reduktion von Molybdän(VI)- und Wolfram(VI)-Salzen in saurer Lösung entstehen nicht-stöchiometrische Verbindungen mit intensiv blauer Farbe. Diese werden als Molybdänblau bzw. Wolframblau bezeichnet. Die Farbreaktion ist u.a. als Nachweis (Vorprobe) gebräuchlich; bei geeigneten Versuchsbedingungen kann sie auch zur quantitativen Bestimmung genutzt werden.
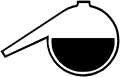
 Molybdänblau zu Beginn der Reaktion |
 Wolframblau nach einigen Minuten |
Geräte und Chemikalien:
Ammoniummolybdat,
Natriumwolframat,
verd. Schwefelsäure,
Zink (gekörnt),
Reagenzgläser.
Durchführung:
Einen Spatel einer löslichen Molybdän(VI)-Verbindung
(z.B. (NH4)6Mo7O24) oder einer
Wolfram(VI)-Verbindung (z.B. Na2WO4)
in einigen Millilitern Wasser lösen und mit etwas verd.
Schwefelsäure ansäuern. Nun einige Körnchen Zink zugeben.
Es tritt eine intensive Gasentwicklung auf. Kurz darauf beobachtet man
blaue Farberscheinungen, beginnend mit tiefblauen Schlieren, die von den
Gasbläschen mitgerissen werden. Schließlich färbt sich
die Lösung von unten nach oben dunkelblau.
Erklärung:
Zink reagiert mit der Schwefelsäure unter Bildung von Wasserstoff
"in statu nascendi". Dieser ist ein starkes Reduktionsmittel und reduziert
MoVI bzw. WVI. Dadurch entstehen Verbindungen,
die das jeweilige Element in unterschiedlicher Oxidationsstufe enthalten
(überwiegend MVI+MV), sowie Oxid- und Hydroxid-Ionen
und Wassermoleküle. Die genaue Zusammensetzung läßt sich meist nicht
bestimmen, es handelt sich in der Regel um nicht-stöchiometrische Substanzen.
Es sind jedoch auch stöchiometrische Molybdänblau-Verbindungen bekannt,
z.B. Mo4O10(OH)2 (mit einer formalen Oxidationszahl
+5,5 für Molybdän). Auch bei vielen anderen Verbindungen treten intensive
Farben auf, wenn ein Element darin in verschiedenen Oxidationsstufen
enthalten ist (z.B. Berliner Blau).
Gefahren:

Schwefelsäure ist ätzend;
Molybdate und Wolframate wirken reizend.
Entsorgung:
Die Lösungen und Rückstände werden als anorganische Schwermetallabfälle entsorgt.
Literatur & Links:
Lehrbücher der Anorganischen Chemie, z.B.:
G. Jander, E. Blasius: "Lehrbuch der
analytischen und präparativen anorganischen Chemie"
F. Umland: "Charakteristische Reaktionen
anorganischer Stoffe"
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Montag, 31. Juli 2006, A. Schunk, GDCh, Frankfurt/Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!