
|
Experiment des Monats
|
Eisen ist brennbar, wenn es eine ausreichend große Oberfläche hat (EdM 04/2007). Sehr fein verteiltes Eisen entzündet sich spontan an der Luft und heißt deshalb pyrophores Eisen. Pyrophores Eisen kann durch Erhitzen von Eisenoxalat hergestellt werden. Eisenoxalat fällt beim Vereinigen gesättigter Lösungen von Eisen(II)sulfat und Ammoniumoxalat aus.
 |
 |
Geräte und Chemikalien:
3 Bechergläser, Rundfilter, Filternutsche, Saugflasche, Wasserstrahlpumpe
(oder Glastrichter und Erlenmeyerkolben);
Reagenzglas (schwerschmelzbar), Reagenzglashalter, Bunsenbrenner, Glaswolle,
ggf. Gummistopfen;
Eisen(II)sulfat oder
Mohrsches Salz,
Ammoniumoxalat.
Durchführung:
14 g (NH4)2(C2O4)
in 350 ml Wasser lösen. Eine Lösung von 28 g
FeSO4·7H2O in 80 ml Wasser
(oder 40 g Mohrsches Salz in 120 ml Wasser) zugeben.
Die Lösung leicht erwärmen.
Es fällt hellgelbes Fe(C2O4) aus. Dieses
dekantieren und abnutschen oder abfiltrieren, mit Wasser waschen und
gut trocknen.
Ein schwerschmelzbares Reagenzglas 1-3 cm hoch mit trockenem
Eisenoxalat füllen und mit etwas Glaswolle verschließen.
Das Reagenzglas mit dem Bunsenbrenner so lange erhitzen, bis sich das
gelbe Pulver vollständig nach schwarz verfärbt hat.
(Im entstehenden Gas lässt sich CO2 nachweisen!)
Zur sofortigen Verwendung das Reagenzglas nur kurz abkühlen lassen,
die Glaswolle entfernen und in einem abgedunkelten Raum mit einigem Abstand
über einer feuerfeste Fläche ausgießen. Es entsteht ein
Funkenregen aus orange-rot glühenden Partikeln.
Das pyrophore Eisen kann auch einige Zeit aufbewahrt werden. Dazu das
heiße Reagenzglas mit einem Stopfen verschließen oder zuschmelzen.
Erklärung:
Eisenoxalat zersetzt sich in der Hitze unter CO2-Abgabe:
Fe(C2O4)
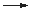 FeO + CO + CO2
FeO + CO + CO2
Dabei entsteht Eisen(II)oxid, das beim Abkühlen zu metallischem Eisen
und Eisenhammerschlag (einem Mischoxid) disproportioniert:
4 FeO 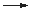 Fe + Fe3O4
Fe + Fe3O4
Dieses Gemisch ist besonders fein verteilt und enthält metallisches Eisen,
das mit Luftsauerstoff spontan zu Eisen(III)oxid verbrennt:
4 Fe + 3 O2 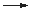 2 Fe2O3
2 Fe2O3
Die Oxidation ist stark exotherm; durch die freiwerdende Energie glühen
die Eisenoxid-Partikel hell auf.
Gefahren:


Ammoniumoxalat ist gesundheitsschädlich, das pyrophore Eisen ist
selbstentzündlich.
Entsorgung:
Die Rückstände können zum Hausmüll gegeben werden.
Literatur & Links:
H. Brandl: "Trickkiste Chemie"
- S. 33-36
F. Bukatsch, O. Krätz, G. Probeck, R. Schwankner: "So interessant
ist Chemie" - Versuch 70, S. 87-88
H. W. Roesky, K. Möckel: "Chemische
Kabinettstücke" - Versuch 10, S. 25-26
G. Wagner: "Chemie in faszinierenden Experimenten"
- Versuch 54, S. 64-66
| Herrn Fritjof Schmock und Herrn Harald Donath,
Fachbereich Chemie der
Philipps-Universität Marburg, danke ich sehr herzlich für die Unterstützung. |
November 2007: Hydrolyse von Stärke und Zellulose
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Freitag, 30. November 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!