Experiment des Monats
März 1998
Energiespeicherung durch chemische Systeme

|
Experiment des Monats |

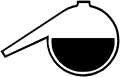
Wird Kobaltchlorid in Alkohol gelöst, liegt ein tetraedrischer Chloro-Komplex vor, dieser ist tiefblau gefärbt. Wird Wasser zugegeben, kann sich der rötliche oktaedrische Aqua-Komplex bilden. (Kolben links, in der Projektion rechts) Dieser Komplex ist jedoch thermisch instabil, bei Temperaturerhöhung verschiebt sich das Gleichgewicht zum blauen tetraedrischen Komplex (rechter Kolben). Dieser Vorgang kehrt sich bei Abkühlung wieder um, die Lösung färbt sich wieder rot.
[Co(H2O)6]2+ + 2 Cl- + 2 iPrOH
 [Co(iPrOH)2Cl2] + 6 H2O
[Co(iPrOH)2Cl2] + 6 H2O
Geräte und Chemikalien:
Kobalt(II)chlorid-Hexahydrat,
2-Propanol (Isopropylalkohol)
Becherglas oder Erlenmeyerkolben
Durchführung:
3 g CoCl2  6 H2O in 50 ml 2-Propanol lösen,
es entsteht eine tiefblaue Lösung. Nun so lange Wasser zutropfen, bis sich die Lösung
rosa färbt, es bildet sich der Aqua-Komplex. Bei Temperaturerhöhung verschiebt sich
das Gleichgewicht zum tetraedrischen Chlorokomplex: Die Lösung färbt sich blau.
Diese Reaktion ist reversibel.
6 H2O in 50 ml 2-Propanol lösen,
es entsteht eine tiefblaue Lösung. Nun so lange Wasser zutropfen, bis sich die Lösung
rosa färbt, es bildet sich der Aqua-Komplex. Bei Temperaturerhöhung verschiebt sich
das Gleichgewicht zum tetraedrischen Chlorokomplex: Die Lösung färbt sich blau.
Diese Reaktion ist reversibel.
Der Versuch eignet sich auch als Projektionsversuch: Die Lösung in einen Erlenmeyerkolben
füllen und auf den Tageslicht-Projektor (Overhead) stellen. Bei Geräten älterer
Bauart genügt die Erwärmung der Oberfläche zum Farbumschlag. Bei neueren
Geräten muß mit einer Heizplatte oder einem Fön nachgeholfen werden. Es ist darauf
zu achten, daß der Alkohol nicht zu sehr verdunstet, daher sind Petrischalen etc. zur
Durchführung ungeeignet.
Hinweis:
Statt Kobaltchlorid kann auch Kobaltnitrat verwendet werden.
In diesem Fall muß ein Spatel NaCl zugegeben werden.
| Gefahren: |

|

|
Entsorgung:
Die Lösung zum Schwermetallabfall geben.
Literatur:
Spears, L. Gene; Spears, Larry G.: "Chemical Storage of Solar Energy Using an Old Color"
Journal of Chemical Education,
61 (1984), 252-254
"Gmelins Handbuch der Anorganischen Chemie", 8. Aufl., Kobalt Bd. A 1,
hrsg. von R. J. Meyer
Berlin: Verlag Chemie, 1932 - S. 287-291
 zurück zum aktuellen Experiment
zurück zum aktuellen ExperimentSeite erstellt am: Montag, 2. März 1998,
A. Schunk.