
|
Experiment des Monats
|
Cystein gehört zu den 20 proteinogenen Aminosäuren. Die HS-Gruppe kann leicht oxidiert werden. Aus zwei Cystein-Molekülen entsteht dabei das dimere Cystin. Die Dimerisierung kann auch zwischen zwei Cystein-Resten in einer Proteinkette erfolgen. Solche Disulfid-Brücken sind von großer Bedeutung bei der Stabilisierung der Tertiärstruktur von Proteinen.
 |
 |
 |
Geräte und Chemikalien:
Cystein,
Natriumhydrogencarbonat,
Eisen(III)chlorid
Erlenmeyerkolben mit Stopfen.
Durchführung:
2,1 g NaHCO3 in 50 ml Wasser lösen.
1 g Cystein zugeben. Sobald das Cystein gelöst ist,
FeCl3-Lösung zutropfen, bis eine intensive
violett-Färbung vorliegt. Den Kolben mit einem
Stopfen verschließen. Nach kurzer Zeit entfärbt sich
die Lösung. Beim Schütteln des Kolbens (evtl. Stopfen
öffnen), erscheint die violette Färbung wieder und
entfärbt sich erneut. Der Vorgang läßt sich
mehrfach wiederholen. Nach einiger Zeit bildet sich ein
weißer Niederschlag aus Cystin.
Erklärung:
Die SH-Gruppe des Cysteins wird durch Fe3+-Ionen
oxidiert. Es entstehen dabei Cystin und Fe2+-Ionen.
Cystein bildet mit Fe(III)-Ionen einen violetten Komplex;
der Fe(II)-Cystein-Komplex ist farblos. Fe(II) kann durch
Luftsauerstoff wieder zu Fe(III) oxidiert werden. Die violette Farbe
kehrt zurück. Cystin kann keinen Eisenkomplex bilden;
ist alles Cystein zu Cystin oxidiert, kommt die Reaktion zum Erliegen.
2 Fe3+ + 2 Cys-SH 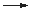 2 Fe2+ + Cys-S-S-Cys + 2 H+
2 Fe2+ + Cys-S-S-Cys + 2 H+
2 Fe2+ + ½ O2 + 2 H+ 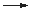 2 Fe3+ + H2O
2 Fe3+ + H2O
Diese Reaktion wird auch im Organismus als Redox-System genutzt. Das Tripeptid Glutathion dient in den Erythrozyten zur Reduktion von Methämoglobin (enthält Fe(III)-Ionen in einem Häm-System) zu Hämoglobin (mit Fe(II)-Häm-Komplexen). Glutathion besteht aus je einem Molekül Glutamat, Cystein und Glycin, wobei zwischen Glutamat und Cystein eine γ-Peptid-Bindung vorliegt, d.h. die Carboxylgruppe der Seitenkette ist an Cystein gebunden.
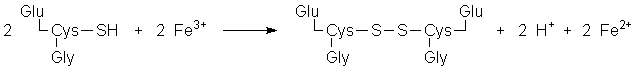
Bei der Anlagerung von O2 an die Fe(II)-Häm-Komplexe des Hämoglobins wird eine koordinative Bindung ausgebildet (es entsteht ein O2-Eisen-Komplex), Fe(II) wird dabei nicht oxidiert. In einzelnen Fällen kann es doch zu einer Oxidation kommen, es entsteht dann Methämoglobin. Dieses kann keinen Sauerstoff transportieren und muß daher - durch Glutathion - wieder reduziert werden.
Gefahren:

Eisen(III)chlorid ist ätzend,
Natriumhydrogencarbonat reizend.
Entsorgung:
Die Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
H. Brandl: "Trickkiste Chemie"
- S. 110-112
Chemie für Mediziner: Aminosäuren & Proteine
April 2005: Reduktion von Permanganat
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Samstag, 30. April 2005, A. Schunk, GDCh, Frankfurt/Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!